Wenn Sie glauben, die Chinesen hätten in einer Verschwörung mit Bill Gates das SARS-CoV-2-Virus erzeugt, um dann durch mRNA-Impfungen die DNA aller Menschen auf der Welt zu manipulieren und Schritt für Schritt die Kontrolle über Leben und Sterben auf der ganzen Erde – die übrigens flach ist – zu erreichen, dann lesen Sie diesen Artikel bitte nicht. Wenn Sie aber noch einen Rest Vertrauen in ernsthafte Wissenschaftsforschung haben, sich allerdings von der ständigen Informationsflut von allen Seiten überrollt fühlen, so daß man gar nicht mehr weiß, was man jetzt glauben soll, dann wird das Folgende Ihnen vielleicht einige neue Erkenntnisse bringen und Ihnen Stichworte in die Hand geben, mit denen Sie sich weiter informieren können.
Im Sommer 2022 gelang chinesischen Forschern eine wichtige Erkenntnis bei der Diagnose und Behandlung von Lungenkrebs, der immer noch die mit Abstand häufigste Krebstodesursache in China und weltweit ist. Denn während der Covid-19-Pandemie waren viel mehr Computertomographien zur Diagnose coronabedingter Lungenveränderungen durchgeführt worden als zuvor. Ein wichtiger Nebeneffekt: Es wurden dabei auch viel mehr frühe Stadien von Lungenkrebs entdeckt, wie der Direktor des Lungenkrebsdiagnose- und Behandlungszentrums an der Beijinger Medizinischen Universität, Zhi Xiuyi, auf der „cancer prevention and treatment awareness week“ am 15.–22. April berichtete.1 Er betonte dabei, daß eine frühe Diagnose ausschlaggebend sei für den Erfolg oder Mißerfolg bei der Behandlung von Lungenkrebs.
Die Früherkennung von Lungenkrebs eröffnet auch einem neuen Therapieverfahren einen wichtigen Ansatz, bei dem China weltführend ist, nämlich der Methode, mit individualisierter mRNA-Impfung den Tumor kontrolliert am Wachstum zu hindern.2
Hierfür werden genetische Tests an den Krebszellen durchgeführt, um Mutationen herauszufinden und eine Therapie zu entwickeln, die das Immunsystem in die Lage versetzt, eigenständig die Krebszellen zu bekämpfen. Zhi betonte, daß auf diese Weise vielen Krebspatienten auch in fortgeschritteneren Stadien zu einer längeren Überlebensrate und einer besseren Lebensqualität verholfen werden kann.
Ein weiterer großer Fortschritt gelang in China auch bei der Behandlung von Gehirntumoren (Glioblastoma). Durch den extrakraniellen Einsatz von spezifischer mRNA konnten im Versuch mit Mäusen Gehirntumore zum Schrumpfen gebracht werden.3
Diese Beispiele sind nur einige von den weltweit auf Hochtouren laufenden immunologischen Forschungen zur Behandlung von viralen Erkrankungen und Krebs. Wie ist es zu den neuen Erkenntnissen gekommen, was hat das mit dem Immunsystem zu tun und wann sind diese Therapien einsatzbereit?
Neue Erkenntnisse mit Immuntherapien
Normalerweise erkennen unsere körpereigenen Abwehrmechanismen sofort, wenn fremde Zellen in den Körper eindringen. Sie werden umgehend bekämpft und ausgeschaltet. Bei Krebszellen ist das anders, denn sie können den Abwehrzellen auf verschiedenen Wegen ausweichen. Eine Immuntherapie soll also bewirken, daß das Immunsystem eines Patienten auch Krebszellen erkennen und angreifen kann. Bei verschiedenen Tumorarten haben spezielle Immuntherapien bereits gute Wirksamkeit gezeigt, darunter das maligne Melanom (schwarzer Hautkrebs), Lungenkrebs, Nierenkrebs, triple-negativer Brustkrebs und einige Formen von Blutkrebs. Oftmals kann in Patienten, die gut auf die Immuntherapie angesprochen haben, der Krebs für lange Zeit unter Kontrolle gehalten werden.
Dabei muß betont werden, daß es sich bei den sogenannten Krebs-Impfungen, um die es bei den Immuntherapien geht, immer um therapeutische Impfungen handelt, also nicht um vorbeugende wie bei der Grippe- oder Tetanusimpfung. Krebsimpfungen können nur bei schon bestehender Erkrankung eingesetzt werden. Dabei kommen viele unterschiedliche Methoden zum Einsatz, die zum Teil noch in der Erforschung sind oder ganz neue Forschungsbereiche eröffnet haben, so die Nutzung der sehr aktiven RNA. Einige davon könnten bereits in wenigen Jahren angewendet werden. Dabei wird die Tatsache ausgenutzt, daß Krebszellen gegenüber gesunden Zellen verändert sind, also oft neue oder einfach nur fremde Strukturen auf ihrer Oberfläche haben, wobei es sich meist um Eiweiße handelt, „Antigene“ genannt. Das Immunsystem könnte diese theoretisch erkennen, wenn es sie als „fremd“ identifiziert hat, und eben dafür braucht man angesichts der äußerst trickreichen und gut getarnten Krebszellen einen Anstoß.
Beispiele für derzeit in Studien untersuchte Ansätze sind Protein-/Peptid-basierte Impfungen, bei denen dem Patienten als Antigen ein geeignetes tumortypisches Eiweiß (Protein) bzw. ein Eiweiß-Abschnitt (Peptid) verabreicht wird. Die Antigen-präsentierenden Zellen (APCs), z. B. die dendritischen Zellen im Gehirn, sollen dieses Eiweiß nun aufnehmen und als Abwehrreaktion passende T-Zellen aktivieren und zur Teilung anregen. Die zytotoxischen T-Zellen greifen dann die Tumorzellen direkt an, die dieses Antigen tragen.
Auf ähnliche Weise funktioniert auch eine weitere Immuntherapie, die mRNA-basierte Impfung, die wir bereits in der letzten Ausgabe von FUSION beschrieben haben. Statt des Eiweißes selbst wird dem Patienten dabei nur die „Bauanleitung“ eingegeben, so daß dieses „fremde“ Eiweiß von den Körperzellen selber hergestellt wird und die Abwehrreaktion des Immunsystems in Gang kommt.
Die Immuntherapie mit mRNA
Die geniale Idee, mRNA-Boten zu benutzen, um das Immunsystem gegen Viren oder Krebszellen zu aktivieren, entstand schon in den 60er Jahren. Sie beruht auf der Entwicklung in der Biochemie, der Entdeckung von DNA und der sehr aktiven RNA. Doch wurde dieser Forschungsbereich jahrzehntelang nur wenig gefördert, denn wie es bei allen durchgreifenden Ideen geht: Politiker und auch große Köpfe der Wissenschaft erkennen nicht das Potential, können meist gar nicht mehr über ihr „Fach“ hinaus denken. Und alles, was Geld kostet, wird gerne erst einmal nicht beachtet.
Als gegen das neue, hochgefährliche Sars-CoV-2-Virus ein Impfstoff entwickelt werden sollte, griff man auf diese neue Medizinforschung zurück, die mRNA gegen das neue Virus zu mobilisieren, praktisch zu „impfen“. Weltweit wird nun intensiv daran geforscht, um mRNA-basierte Impfstoffe gegen viele weitere proteinbasierte Antigene zu finden, nicht nur gegen Krebszellen und Grippeviren, sondern auch gegen viele andere virusbedingte Infektionskrankheiten.
Das Prinzip der mRNA-Technologie ist eigentlich sehr einfach: sie benutzt die im menschlichen Immunsystem ständig aktiven Botenstoffe (messenger RNA) der Ribonukleinsäure, indem sie sie mit dem Bauplan für ein bestimmtes Protein der zu bekämpfenden Krebsart ausstattet. Die Botenstoffe dringen bei der Impfung in die Zellen an der Einstichstelle ein, und diese produzieren daraufhin eine Zeit lang dieses Protein, welches das menschliche Immunsystem als Fremdkörper erkennt und bekämpft, und sich für die Zukunft als Fremdkörper merkt.
Bei der Krebstherapie dienen die mRNA-Impfstoffe aber nicht der Vorbeugung, wie bei einer Impfung, sondern sie können hier nur bei der Behandlung einer schon bestehenden Erkrankung aktiv werden. Die mit einem Krebseiweiß präparierten Botenstoffe sollen das Immunsystem dazu bringen, bösartige Zellen zu erkennen und zu zerstören, doch ist das bei Krebs viel komplizierter als bei der Impfung gegen Corona mit seinem deutlich als Fremdkörper erkennbaren Spike-Protein, denn Krebszellen sind den gesunden Zellen oft sehr ähnlich, außerdem können sie sich tarnen oder das Immunsystem bremsen. Deshalb ist es viel schwieriger, einen mRNA-Impfstoff gegen einen körpereigenen Krebs zu entwickeln als einen Impfstoff gegen einen Angreifer von außen.
„Bei einer Impfung gegen Krebs spritzen wir den Bauplan für ein Protein, das für diesen Tumor spezifisch ist,“ erklärte Niels Halama, Leiter der Abteilung „Translationale Immuntherapie“, Oberarzt und Leiter der Forschungsgruppe „Adaptive Immunotherapie“ am Nationalen Centrum für Tumorerkrankungen (NCT) Heidelberg.
Halama weiter: „… Bei einem Tumor, den die Immunzellen zwar erreichen können, aber nicht angreifen, … reicht es hoffentlich, ihnen mit der Impfung wieder zu zeigen, was sie erkennen sollen. Die Impfung muß dann so designed sein, daß der Körper das Signal erhält, hier besonders aktiv zu werden. Die Zielstruktur bekommt dann gewissermaßen das Label ,besonders gefährlich‘. Dazu bietet die mRNA-Technologie verschiedene Möglichkeiten, und das ist auch eine ihrer Stärken.“
Bei der Krebsbekämpfung gibt es aber weitere Probleme, denn Tumore haben kein einheitliches Oberflächeneiweiß, gegen das man alle Patienten mit dem gleichen Stoff impfen könnte. Bei der mRNA-Impfung gegen SARS-CoV-2 war das Spike-Protein auf der Oberfläche des Virus dagegen als geeignetes Antigen schnell entdeckt. Bei Tumorzellen ist das erheblich schwieriger. Sogar innerhalb einzelner Krebsarten ist es oft schwierig, ein Zielprotein auszumachen, das bei allen Patienten gleich ist. Es muß also eine sehr individuelle Therapie entwickelt werden – die Erzeugung einer patientenspezifischen mRNA.
Grundsätzlich stellt sich hierbei die Frage, wie unser Immunsystem eigentlich Viren und Bakterien erkennen kann und was die RNA damit zu tun hat.
Unsere DNA, ein komplexer Apparat
Am Anfang stand die Entdeckung der DNA (Desoxy-Ribonukleinsäure) in den 1950 Jahren durch vier Forscher, Rosalind Franklin, James Watson, Francis Crick und Maurice Wilkins, die herausfanden, daß die scheinbar wahllose Anordnung von Basen in einer Doppelhelix eine geordnete Verschlüsselung der gesamten genetischen Grundlagen unseres Körpers darstellt.
Sehr schnell ergaben sich daraus Tausende neue Aspekte, vor allem was die aktive Rolle der RNA angeht, die größtenteils als einsträngige Helix angeordneten Basenpaare der Ribonukleinsäure. Sie besteht wie die DNA aus den Bausteinen Adenin, Guanin, Cytosin und Thymin, wobei bei der RNA das Thymin durch Uracil ersetzt ist (siehe Abbildung 1). Die Basen sind jeweils durch das Zuckermolekül Ribose (bei der RNA) bzw. Desoxyribose (bei der DNA) und einem Phosphat miteinander verknüpft.
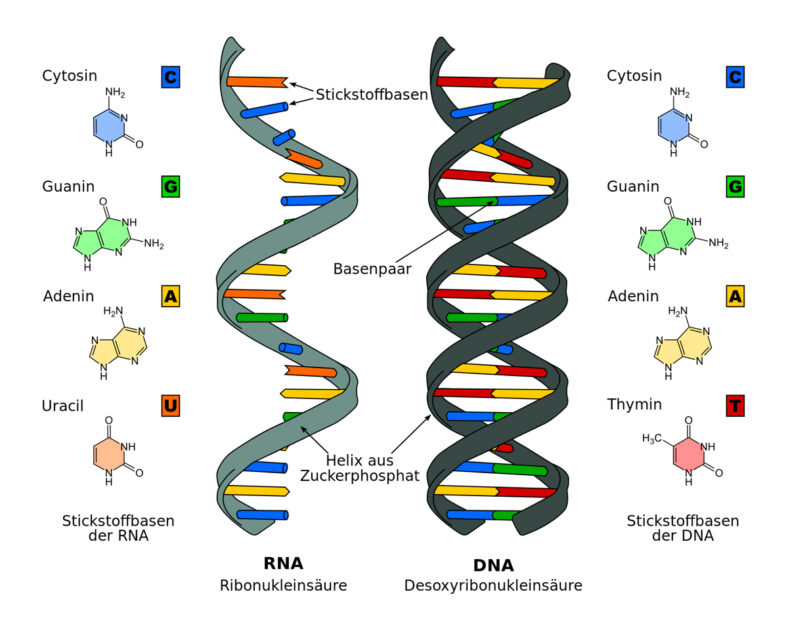
Das Besondere an der RNA ist, daß ihre Einzelsträngigkeit die Zahl der Möglichkeiten für dreidimensionale Strukturen erhöht und ihr die Katalyse chemischer Reaktionen erlaubt. Außerdem fehlt ihr eine Hydroxylgruppe, was sie viel weniger stabil als die DNA macht.
Was hat das alles mit unserem Immunsystem zu tun? Heute wissen wir, daß es zwei verschiedene Immunsysteme gibt, nämlich das angeborene (innate) und das erworbene (adaptive) Immunsystem. Das erworbene Immunsystem besteht in der Fähigkeit, im Laufe des Lebens spezifische Rezeptoren (das sind Zellen oder Zellbestandteile, die auf bestimmte Reize reagieren und Signale weiterleiten) neu zu bilden, indem mit Hilfe der Selektion von T- und B-Zellen verschiedene Gen-Abschnitte neu miteinander verknüpft und rekombiniert werden. Dadurch entstehen bei jedem Angriff durch unbekannte Krankheitserreger neue Proteine, die bestimmte Proteinstrukturen mit hoher Spezifität erkennen. Die resultierenden Rezeptoren sind die T-Zell-Rezeptoren (TCR) und die B-Zell-Rezeptoren (BCR) bzw. die dann abgesonderten Antikörper. Das erworbene Immunsystem bildet also ein ausgeklügeltes System für die Erkennung neuer Proteinstrukturen, mit denen der Körper noch nie vorher in Kontakt war.
Das angeborene Immunsystem basiert auf wichtigen Ergebnissen der neuesten biochemischen und medizinischen Forschung über DNA und RNA. Man hat Rezeptoren identifiziert, die in der DNA schon bei Lebensbeginn angelegt sind und die selbstständig molekulare Strukturen eingedrungener Krankheitserreger erkennen. Diese angeborene Immunität oder Nukleinsäure-Immunität ist ein ganz junges Forschungsgebiet, das viele Türen für die Behandlung bisher schwer oder unheilbarer Krankheiten öffnet. Professor Gunther Hartmann aus Bonn hat sich erst jüngst mit dieser Aktivität der RNA näher zu beschäftigen begonnen.4
Neben der Proteinsynthese selbst5 ist noch eine andere Aktivität der RNA bedeutsam für das Leben unseres Organismus: die ständige Erkennung und Abwehr fremder Nukleinsäuren, die den Organismus bedrohen. Hierbei wird das Erbgut von Viren, das oft in Form von RNA vorliegt, von unserer angeborenen Immunabwehr erkannt. Am Tag der Immunologie im April 2017 sagte Prof. Hartmann in einem Interview mit dem Bonner General-Anzeiger:
„Es gibt eine angeborene Immunität, die sicherstellt, daß das gröbste aus dem Weg geschafft wird, was an Krankheitserregern in den Körper eindringt. Und dann gibt es die erworbene Immunität, ein sehr ausgeklügeltes System, bei dem sich die Sinnesrezeptoren innerhalb weniger Tage ganz neu entwickeln, und das durch die Alarmsignale der angeborenen Immunität gesteuert wird. Jetzt kann man sich vorstellen, daß nicht ein, zwei Rezeptoren ausreichen für die Erkennung der Vielzahl der Krankheitserreger. Es gibt ein ganzes Arsenal an angeborenen Rezeptoren, die eine Vielzahl an Krankheitserregern direkt erkennen. Das Wissen darüber ist erst in diesem Jahrtausend entstanden. Jedes Jahr werden neue Mechanismen entdeckt, die uns helfen zu verstehen, wie das Immunsystem genau funktioniert, so daß wir es noch besser im Sinne der Gesundheit einsetzen können… Es gibt eine ganz bedeutende Entwicklung bei der Immuntherapie von Tumoren. Die hat lange Zeit ein Schattendasein geführt. Der größte Durchbruch in der Therapie von Tumorerkrankungen kommt aber nun gerade über Eingriffe in das Immunsystem“.6
Erst in den letzten Jahren erkannte man genauer, wie eigentlich die Unterscheidung von fremden und eigenen Nukleinsäuren im Organismus vor sich geht, und man war erstaunt, wie präzise jede Zelle mit Hilfe der RNA permanent das eigene Cytoplasma auf fremde Nukleinsäuren kontrolliert. Zum Beispiel können die Zellen eines Menschen richtig ungemütlich reagieren, wenn etwa Bakterien oder Malariaerreger eindringen, indem sie z. B. reaktiven Sauerstoff freisetzen und so versuchen, die Eindringlinge wieder rauszuwerfen – ein Prinzip, das auch in WC-Reinigern und Desinfektionsmitteln benutzt wird. Die Zelle befindet sich dann in einem richtigen Ausnahmezustand: Sie versetzt sich selbst in eine Art Quarantäne und produziert Entzündungsbotenstoffe, die noch andere Immunzellen anlocken und aktivieren. Diese Immunzellen können dann ihrerseits infizierte Zellen abtöten oder Antikörper gegen die Erreger bilden und so die Infektion langfristig bekämpfen.
Doch wie erkennt die lebende menschliche Zelle, ob überhaupt unerwünschte Stoffe eingedrungen sind? Es gibt einen Sensor des Immunsystems mit dem wissenschaftlichen Namen „TLR8“ (Toll-like-Rezeptor 8), der wie ein Radarsystem darüber wacht, ob beim Recycling von abgestorbenen Zellen verräterische Ribonukleinsäuren auftauchen, die auf körperfremde Eindringlinge hinweisen. „Toll-like“ bedeutet, daß diese Aufpasser- bzw. Sensor-Rezeptoren wie äußerst strenge Zollbeamte arbeiten, die Stoffe nur nach akribischer Prüfung durch die Zollschranken hindurchlassen.
Wie beim Verdauungsvorgang werden nämlich auch ganze Zellen und Zellbestandteile, die nicht mehr gebraucht werden, in ihre Einzelbestandteile zerlegt und wieder zu neuen Zellstrukturen zusammengebaut. Haben sich Bakterien oder Malariaerreger in diesen Bestandteilen versteckt, gelangen sie beim Recyclingverfahren aufgrund ihrer andersartigen Ribonukleinsäuren auf den Radarschirm der TLR8. In einer Veröffentlichung der Universität Bonn vom 14. April 2020 beschreibt Dr. Eva Bartok, wie man diesen besonderen Mechanismus für die Krebsbekämpfung einsetzen könnte:
„Das Zusammenspiel der RNaseT2 und der RNase2 mit dem Immunsensor TLR8 ist ein Schlüsselelement der Immunreaktion gegen Erreger im Inneren von Zellen“, sagt Bartok. „Auf der Grundlage dieser Erkenntnis könnten möglicherweise neue Impfstoffe gegen Infektionen oder Immuntherapien gegen Krebs entwickelt werden, indem TLR8 über maßgeschneiderte RNA-Moleküle stärker aktiviert und somit die Abwehr mit einem Turbo versehen wird…“7

An anderer Stelle hat Prof. Hartmann erklärt, wie man zu den Erkenntnissen über die Nukleinsäure-Immunität gekommen ist:
„Schon in den 1970ern ist aufgefallen, daß isolierte bakterielle DNA, wenn sie in eine Zelle gelangt, eine Interferon-Antwort auslösen kann. Das war damals ein erstaunlicher Befund. Heute kennen wir Interferon als klassisches und wichtigstes antivirales Cytokin. Es ist auch das erste Cytokin, das überhaupt entdeckt wurde. Der Name kommt daher, daß das Interferon eben mit Assays zur Virenvermehrung interferiert. Mit Interferon replizieren die Viren auf einmal nicht mehr. Interferon ,interferiert‘ also mit der Virusreplikation. Und es versetzt das gesamte System in einen Alarmzustand, weil es anzeigt, daß gerade ein virales Pathogen unterwegs ist.
RNA ist sehr labil, daher hat man das erst über die DNA bemerkt. DNA mit nicht-methylierten CpG-Motiven induziert besonders stark das Interferon. Später sah man das auch für RNA. Der Sinn dahinter ist, zu verhindern, daß virale RNA translatiert wird [d. h. weiterproduziert und in die Zellen eingeschleust wird, C. H.] und somit virale Proteine gebildet werden. Wenn die Zelle das verhindert, kann ein Virus natürlich auch nicht replizieren.“8
Diese Erkenntnis hat ein weites Feld für die Diagnose von Krankheiten eröffnet – die Nukleinsäurediagnostik. Man kann heute schon im Blut feststellen, welche Nukleinsäuren als fremd identifiziert wurden, ob sie eigene (bei Autoimmunkrankheiten zum Beispiel) oder tatsächlich fremde sind. Außerdem ergibt sich daraus für die Therapie verschiedenster viraler Erkrankungen bis hin zu Krebs eine ganz neue Perspektive.
Für eine treffsichere Erkennung fremder Nukleinsäuren braucht die RNA drei Arten von Informationen: ihre Menge, ihren Ort sowie ganz bestimmte Struktur-Komponenten. Diese drei Informationsarten aktivieren eine gezielte antivirale Immunantwort gegen eindringende Fremd-Nukleinsäuren (meist Viren oder intrazelluläre Bakterien), wie zum Beispiel die Produktion von Interferon-alpha und Interferon-beta, und von Interferon-induzierten Genen (siehe Abbildung 2). Man konnte feststellen, daß alle bis heute bekannten Mechanismen der Immunerkennung von DNA und RNA und der nachfolgenden Induktion von Typ-I-IFN (Typ-I-Interferon) von sieben Rezeptoren gesteuert werden, die der sogenannten Familie der „Toll-artigen Rezeptoren“ angehören. Sie tragen beim Menschen zur Nukleinsäure-Immunität bei.
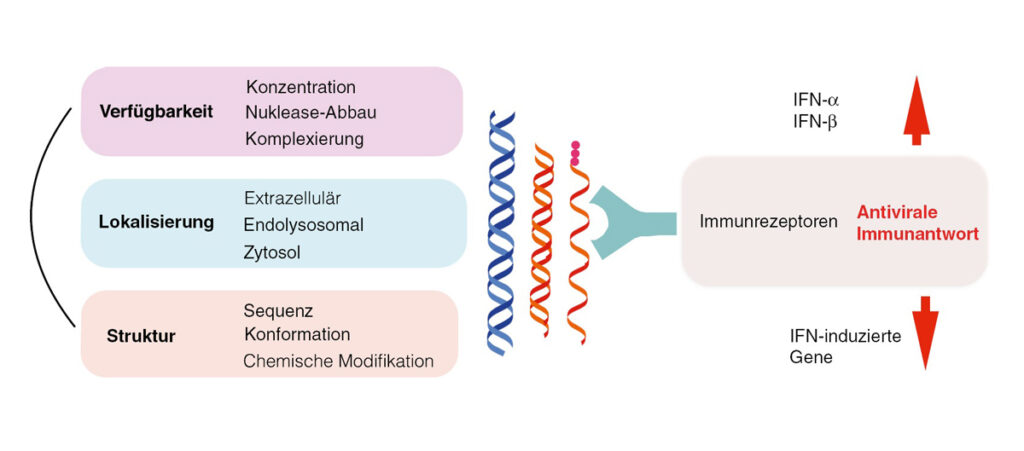
Nukleinsäuren werden als neuartige Therapieformen in der Medizin immer wichtiger. Aufbauend auf Erkenntnissen der Nukleinsäure-Immunabwehr, die auf molekularer Ebene nachgewiesen werden konnten, ist es dem Team um Hartmann inzwischen gelungen, spezielle immunstimulatorische RNA-Moleküle zu entwickeln, die eine Virusinfektion nachahmen und so bestimmte Immunreaktionen auslösen. Der Körper wird also dazu animiert, sich selbst zu helfen.
Dies könnte gezielt für therapeutische Zwecke genutzt werden, doch die Forscher haben darüber hinaus einen Weg gefunden, diese RNA-Moleküle mit Eigenschaften der RNA-Interferenz zu kombinieren. Dadurch üben sie zwei Funktionen aus: sie stimulieren das Immunsystem und schalten gezielt Gene aus, die beispielsweise für das Überleben von Krebszellen wichtig sind. Beide Therapie-Ansätze sind in Tiermodellen bereits erfolgreich getestet worden. Hartmann und sein Forscherteam unterzogen die RNA-Moleküle einer präklinischen Prüfung, um sie zukünftig als Therapeutika zur Bekämpfung von Virusinfektionen, Krebserkrankungen und Autoimmunerkrankungen einsetzen zu können.
Es wird voraussichtlich noch einige Jahre dauern, bis die Krebsbehandlung mit mRNA-Technologie in der Praxis eingesetzt wird. Als Therapie wird sie dann zunächst wohl nur bei einzelnen Krebsarten in Frage kommen und dann auch nicht allein, sondern in Kombination mit anderen Behandlungsmethoden. Ein Allheilmittel gegen Krebs wird die mRNA-Technologie also (noch) nicht sein. Möglicherweise kann sie aber dazu beitragen, Krebs von einer oft tödlichen zu einer chronischen Krankheit zu machen.
Das Paul-Ehrlich-Institut rechnet damit, daß es in Deutschland in frühestens fünf Jahren eine erste Zulassung für mRNA-Impfstoff gegen Krebs geben wird. Momentan sind jedoch schon 17 klinische Studien gegen Lungen-, Prostata- oder Hautkrebs durchgeführt worden, also jeweils sehr spezielle Krebsarten. Daraus wurden Daten zu möglichen Nebenwirkungen und zur Verträglichkeit gewonnen. Nun muß sich zeigen, wie schnell es gelingen kann, eine individualisierte Impfung gegen Krebs zu entwickeln.
Fußnote(n)
- https://news.cgtn.com/news/2022-04-20/China-makes-breakthroughs-in-lung-cancer-diagnosis-and-treatment–19mhEZLE99u/index.html[↩]
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7438408/[↩]
- https://pubmed.ncbi.nlm.nih.gov/35024442/[↩]
- https://www.degruyter.com/document/doi/10.1515/labmed-2016-0048/html[↩]
- siehe dazu ausführlich Caroline Hartmann, „Die geniale Idee der mRNA-Impfstoffe“, FUSION, Nr. 2, 2021[↩]
- https://ga.de/ratgeber/fit-und-gesund/so-funktioniert-das-immunsystem_aid-43326049[↩]
- https://www.uni-bonn.de/de/neues/090-2020[↩]
- https://www.laborjournal.de/editorials/2446.php[↩]
